治験モニターは怖い?知っておくべきリスクと安全への取り組み
治験は、高額な負担軽減費や自由時間の長さが魅力的な、新薬の開発におけるボランティアの1つと認識されがちです。時にはアルバイトとして募集されていることもあります。
一般的なアルバイトよりも高い報酬を得られることから興味がある人も多くいます。ただその一方で、投与される新薬の安全性や未知の副作用に不安を感じ、治験モニターは怖いというイメージが払拭できず、応募や登録をためらっている人も多いのではないでしょうか。
治験は厳格な審査のもとで実施され、予期せぬリスクや副作用に対しても最大限の注意や予防策が講じられています。
今回は治験モニターの一般的なアルバイトとの違い、リスクや、治験を行う上での安全への取り組みについて紹介します。リスクだけではなく安全性も正しく理解して、治験への参加を判断しましょう。
目次
1.臨床開発における治験モニターの意義(アルバイトとの違い)
多くの人が誕生を心待ちにしている新薬は、長い年月をかけて効果が確認されます。
しかし、理論上はどれだけ効果が証明された薬であっても、ヒトに対して本当に有効であるかどうかはわからないものです。そのため、新薬は最終確認としてヒトへ投与され、有効性や安全性を確認しなければなりません。
治験モニターの存在意義は、新薬の効果を確認するうえで欠かせない、大切なボランティアの役割にあります。一方、アルバイトのように契約に縛られず、参加や途中で辞めることも含め自由に判断できる仕組みができています。
1-1.臨床開発に治験が重要な理由
日本国内で薬を使用するためには、厚生労働省から認可を受けなくてはなりません。そのため、製薬会社は医療機関と協力して、厚生労働省の定めたルールに基づき、新薬の認可を目的とした臨床試験を行います。
治験とはこの臨床試験のことであり、新薬が誰でも使用できる薬であるのかを確認するための重要なプロセスです。
また、副作用やリスクに関する情報を収集し、データ化することも治験の目的の1つです。治験の実施によって得られた結果は、実際に医師が経験則に頼らずに薬を処方するときの確かな指針にもなります。
将来、新薬が安全に使用できるようになるためには、医師や研究者の努力はもちろん、治験の結果を導くボランティアの協力が欠かせません。
1-2.新薬が開発の流れと治験モニターの役割
新薬の開発は、一般的に次のような手順で進めていきます。
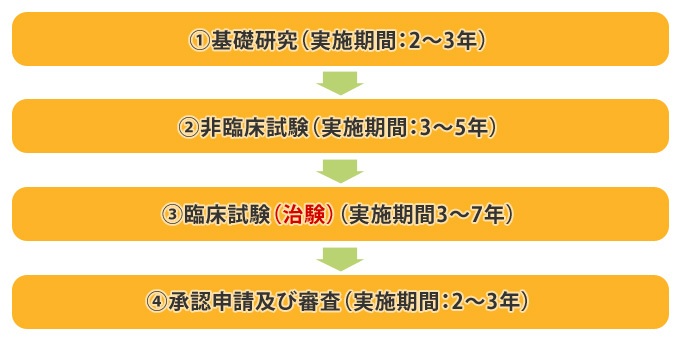
基礎研究では未知の物質や新たな組み合わせを研究して、薬を試作します。基礎研究を経て新薬の有効性や安全性が確認されると、非臨床試験において動物実験を実施し、生物に対する新薬の効果を検証します。
しかし、非臨床試験だけではヒトにも実際に効果があるのかどうかわかりません。そのため、理論上はヒトにも安全であることを確認できた段階で、臨床試験に移ります。
この臨床試験に被験者として参加するのが治験モニターなのです。(これらの被験者は医学・創薬の業界では治験モニター・医学ボランティア・創薬ボランティアなどと呼ばれています。一般には治験アルバイトとか治験バイトとして馴染みがあるかもしれませんが、アルバイトとは異なります。)
どれだけ問題はないと思われる新薬であっても、最後にはヒトを対象とした臨床試験によって安全性や有効性を証明しなければならないのです。
2.治験モニターが知っておくべきリスクについて
治験は臨床試験であるため、リスクがまったくないとは言い切れません。
しかし、治験で用いられる薬は既に海外で利用されているものも多く、生命に危険が及ぶような重篤な副作用が発生するとは考えにくいという研究結果のもとで行われています。
治験の安全性だけではなく、起こりうる副作用やリスクをあらかじめ知っておくことで、治験モニターへの漠然とした不安は軽減されるはずです。
2-1.治験における3つの「安全性」レベル
治験は次の3種類に分類され、段階的に実施します。
| 段階 | 対象となる被験者 | 主な内容 |
|---|---|---|
| フェーズ1 (第1相試験) |
健康な成人(少数) | 薬の有効性や副作用の安全性を確認する |
| フェーズ2 (第2相試験) |
対象となる疾患を持った患者(少数) | 治療薬としての有効かつ安全な投与量、及び投与方法を確認する |
| フェーズ2 (第3相試験) |
対象となる疾患を持った患者(多数) | 薬の有効性や副作用の安全性について、これまでに使用されている薬との比較を行う |
このフェーズとは治験の安全性のレベルを表すものではなく、臨床試験が確認しようとする内容によって分けられています。
事前に健康診断を受検し、健康状態が良好だと判断された成人が治験モニターとして参加する多くの臨床試験がフェーズ1です。登録サイトによって広く募集されている治験モニター(一般に治験アルバイト・治験バイトなどと呼ばれている)はこのフェーズが該当します。フェーズ1では、動物実験によって安全性がある程度証明された薬をはじめてヒトに投与して、ヒトに対する副作用の安全性を確認します。
この安全性を確認したうえでフェーズ2に移行するため、フェーズ1の方がフェーズ2以降よりも治験モニターのリスクは高いといえるでしょう。
そもそもは治験の安全性を提示するためのレベル分けではありませんが、治験の安全性が心配な方は、安全性を判断する一要素として覚えておきましょう。
2-2.治験で起こり得る「有害事象」「副作用」

治験で起こり得るリスクとして挙げられるのが、有害事象と副作用です。
有害事象とは、治験によって薬を投与された被験者に生じる、あらゆる好ましくない事象や意図しない事象、またはその兆候のことです。
有害事象は、治験で投与された薬が原因であるかどうかは関係ありません。治験期間中の食あたりや風邪、場合によっては通院中に遭ったケガなども有害事象に含まれます。
一方、副作用は有害事象のうち、治験による薬によって引き起こされた可能性があり、治験との因果関係が否定できないものを指します。もちろん、あらかじめ想定される軽い副作用はインフォームド・コンセントによって参加者へ事前に知らされるため、心配はありません。
製薬会社や医療機関は、新薬に想定される副作用だけではなく、予期せぬ重篤な副作用が潜む可能性も見落とさないようにしなければなりません。しかし、頭痛や下痢のような症状は薬を投与されなくても起こり得るものも多くあります。そのため、ある症状が本当に副作用であるかどうかを判断することは困難なケースも存在します。
副作用の判断の難しさを鑑みて、厚生労働省は平成24年に「医薬品の臨床試験の実施の基準に関する省令」のガイダンスを発表しました。このガイダンスでは副作用を判断するための参考事例として、投薬中止後の症状の消失や、投薬再開後の症状再発などを挙げています。治験の内容によって判断基準は異なるものの、実際の副作用の判断は基本的にこのガイダンスの参考事例に照らし合わせて行うこととなります。
3.治験での「安全」に対する取り組み・補償
予期せぬ副作用が生じた場合の影響を最小限に抑えるために、治験では医療機関や製薬会社、そして国が連携して治験モニターの安全に対する取り組みを行っています。
有害事象が起こった際も被験者の安全を最優先に緊急処置・報告の手順が提唱されており、医療機関は国の安全基準やルールを守らなければなりません。
また、重篤な副作用が起きた場合でも、経済的な不安を感じる必要はありません。治験で受けたさまざまな被害に対しては、手厚い補償が行われます。
3-1.治験を安全に行うための取り組み・制度

《ヘルシンキ宣言》
現代の医学・薬学では最終的にヒトを対象とした試験によらなければ確認できない事柄がたくさんあります。つまり治験や臨床試験を行うことは医学・薬学の発展の為にまだまだ必要です。その為、世界医師会は主にこの研究に携わる医師に対し、過去の人体実験への反省を鑑み、ヒトを対象とする生物医学的研究について倫理的基盤を定めました。
これをヘルシンキ宣言と呼んでいます。この宣言は1964年に制定されて以来、定期的に見直し検討されています。
特に重要なこととして、・科学的・倫理的に適正な試験実施計画・治験審査委員会による科学的・倫理的な適正さを審査・参加者へ十分な説明と自由意思による同意等が謳われています。
《GCP(good crinical practice)医薬品の臨床試験の実施の基準》
治験は、ルールに基づいて事前に厚生労働省へ実施計画を届け出た上で遵守しなければなりません。
(このルールのことを《GCP(good crinical practice)医薬品の臨床試験の実施の基準》と言います。)
そのため、専門的な知識を持った製薬会社の担当者が、医療機関へ何度も足を運びます。担当者の役目は、治験におけるデータの科学的な正当性や信頼性の確認、そして被験者の人権や安全の確保を通じて、治験が適切に実施されるよう適宜調整することです。
《治験審査委員会(IRB)》
一方、治験の実施計画を審査しているのが、治験審査委員会です。実施計画を承認したあとも、治験審査委員会は年に1回以上、治験が適切に行われているかどうかを審査しています。
もし、治験の実施中に後遺症が残るなどをはじめとする重篤な副作用が起こった場合、医療機関はただちに治験審査委員会と製薬会社へ報告をしなければなりません。報告を受けた委員会は治験の継続可否について審査を行います。また、製薬会社は定められた期間内に、さらに国へ報告をしなければなりません。
このように、治験では医療機関、製薬会社、治験審査委員会、そして国といった複数の立場の関係者が絶えず連携することで、実施計画の管理や安全性の確保を行っています。
《インフォームド・コンセント》
もちろん治験に参加を希望する方には参加前に詳しく当該治験の内容について説明があります。その上で治験への参加は希望者本人が決めることになります。強制などはございませんので、一度同意(参加の意思表示)をした場合でも、いつでも取りやめることができます。
治験の実施中に認められた未知の副作用に関する情報は、参加中の他の被験者にも説明されます。併せて、治験の参加を継続するかどうかの意思を確認されるため、不安や怖さを感じた場合は止めることも可能です。怖いと思ったらその場でスタッフに伝えましょう。なお、一部の例外を除いて、基本的に治験はいつでも止めることができます。
3-2.治験によるリスクに対する補償
厚生労働省が定めた指針《GCP》に基づき、治験の依頼者は健康被害を補償するための要件や手続きを定めなくてはなりません。ここでいう健康被害とは、主に副作用によるものを指します。
治験の補償には、次のようなものがあります。
| 補償の種類 | 主な支給内容 |
|---|---|
| 医療費 | ・健康被害に対する治療費のうち、健康保険などからの給付を除いた自己負担額分 |
| 医療手当 | ・通院にかかる交通費 ・入院に伴う諸雑費 |
| その他補償費 | ・一定以上の障害を負った場合に支給する「障害補償金」 ・死亡した場合に遺族へ支払う「遺族補償金」 ・療養により休業し仕事ができない場合に支給する「休業補償金」 |
もちろん、副作用の確認は厳格に行われます。
しかし、副作用とは「新薬との因果関係が明らかなもの」に限りません。そのため、治験との関係性が完全には否定できないものに対しても、幅広く補償される可能性があるといえるでしょう。
また、因果関係の証明については被験者の負担にならないよう、治験依頼者が行うことになっています。因果関係を恣意的に判断することは禁止されているため、治験依頼者は誠実に検査を行い、客観的なデータを示すことが義務づけられています。
まとめ
治験に用いられる新薬は、理論上は危険がないことをあらかじめ徹底的に確認しています。また、日本国内では未認可であるものの、海外では既に使用されている新薬も多いのです。
万が一のリスクに対しても、参加者への安全に対する取り組みや補償が厳格に定められています。このことを意識すれば、治験モニターへの参加が不用意に怖いと思うものではないことがわかります。
風邪薬を飲むと眠くなるように、人体への副作用を全く持たない薬は基本的に存在しません。そのため、副作用という言葉だけを必要以上に不安がることはないでしょう。紹介したリスクや安全への取り組みから治験が安全だと感じたならば、ぜひ治験モニターへ応募してみましょう。